eConsentを治験で活用していくために 〜入門編〜
DCT入門前回ご紹介差し上げた治験や臨床研究でのオンライン診療の活用の入門記事に引き続き、この記事では被験者の方との同意取得を支援するeConsentと呼ばれるツールについてご紹介していきます。
eConsentとは
治験や臨床研究に参加してもらうためには、被験者の候補となる方との同意を取得する必要があります。治験のリスク等に対して十分に説明し、納得してもらった上で参加してもらうことが必要です。
GCP省令第五十条の中にも「治験責任医師等は、被験者となるべき者を治験に参加させるときは、あらかじめ治験の内容その他の治験に関する事項について当該者の理解を得るよう、文書により適切な説明を行い、文書により同意を得なければならない。」と記載されています。
同意説明文書(Informed Consent Form: ICF)は従来、紙に署名をしてもらう必要がありました。署名をするために、治験を実施する施設まで、被験者の候補の方に来院していただく必要がありました。治験に参加する方を対象にした調査では、通院の負担が大きいことも報告されています。1
出典1:Therapeutic Research Volume 40, Issue 12, 961 – 980 (2019)
わが国における治験実態および患者満足度調査―治験参加前,治験参加後,今後の治験への期待―
署名の電磁化という観点から語られることの多いeConsentですが、本来は説明同意プロセスそのもののオンライン化やデジタル化と捉える必要があります。例えば、署名をする前に、治験について説明する動画を用いて理解を促進したり、オンラインで画面越しに説明同意プロセスを実施することで通院負担を軽減したりすることが期待されています。
今回の記事では、eConsentがどのように治験や臨床研究の場面で役に立つのか、ご紹介していきます。
eConsentを用いるユースケース
同意説明文書を用いる場面としては、下記の通り4つのパターンに分けられます。説明同意プロセスのデジタル化を検討する際に、まず最初に検討されるのが対面でのeConsentの活用です。本当に、そこから検討を始めるのが良いのでしょうか。
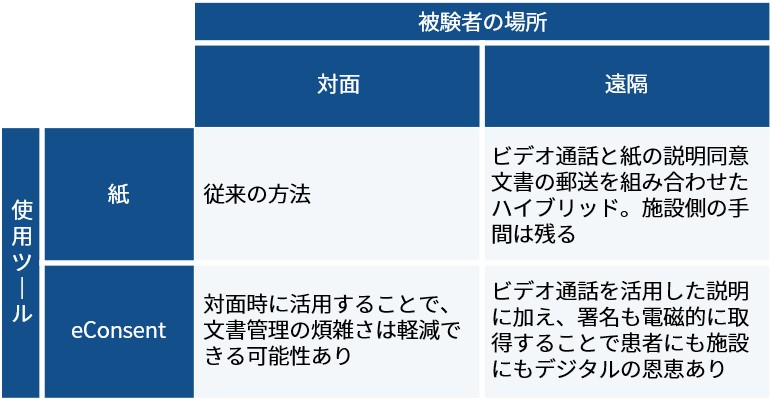
治験プロセスをデジタル化していく際に、忘れてはならないのが治験実施施設の負担の大きさです。eConsentという新しいツールを導入するだけでも負担を強いてしまうのに、さらに遠隔での説明同意プロセスへの対応を求めるのは非現実的だ。こう考え、まずは対面でのeConsentから検討を進められるケースが多いのではないでしょうか。
新しいシステムの費用対効果の観点で考えると、対面でのeConsent活用はメリットがあまりありません。遠隔での説明同意プロセスを可能にし、結果として遠方にお住まいの方でも治験への参加を検討できるようにしてはじめて、案内できる被験者候補の方を増やすことができ、被験者リクルートメントの期間短縮にも繋がります。
製薬企業として、医療機関の負担を考慮しながら対面のeConsentの活用を始めるのか、一足飛びで遠隔でのeConsentの活用を検討するのか、現状のeConsentの普及を考えると頭を悩ませるところだと思います。弊社が実施したアンケートをみても、対面でのeConsent導入を考えている企業は24%ですが、遠隔eConsentになるとその2分の1にまで減ってしまうようです。
治験における同意の遠隔化について悩まれている方は、是非こちらの過去記事も御覧ください。
過去記事:治験における「同意」の遠隔化
eConsentは何の役に立つのか
製薬企業にとっての、被験者リクルートメントの期間短縮という観点をもう少し深堀りしていきましょう。被験者にとって、治験への参加を検討するハードルが下がれば、必要な数の被験者を、より短い期間で募集することも可能になります。治験全体のうち約3分の2は被験者の組入期間が予定よりも伸びていると言われており、eConsent活用による治験期間短縮への期待は大きいようです2。
一方で、被験者にとってのメリットも少なくありません。治験に入ることを検討するためだけに、遠方の医療機関に何度も通院することは、大きな負担になります。遠隔でのeConsentを利用すれば、医療機関に足を運ばずとも治験の説明をうけ、同意取得プロセスを進められます。
最後に医療機関にとってのメリットですが、eConsentの導入だけに着目すると、医療機関にとっては業務負荷が高まることになります。新しいデジタルツールの導入に伴い、標準作業手順書(Standard Operating Procedures: SOP)のアップデートやマニュアルの作成も必要になります。デジタル化されることで、説明同意文書の版管理の煩雑さが軽減される、というメリットは比較すると小さなものになります。
出典2:Trials. 2022 May 12. Success and failure factors of patient recruitment for industry-sponsored clinical trials and the role of the electronic health records-a qualitative interview study in the Nordic countries
治験で実施するにあたって気をつけるべきこと
eConsentを治験に組み込む際には、いくつか気をつけておくべきことがあります。特に、医療機関での導入が初めての場合、負担が大きくならないようサポートすることも重要です。
全ての医療機関にeConsentを導入するのではなく、紙での説明同意文書を用いる施設とeConsent施設とのハイブリッド運用が現実的でしょう。IRBへの提出ドキュメントの内容であったり、eConsentと併用する治験説明動画の内容なども、検討が必要な項目になります。サテライト施設を活用する場合には、さらに別の論点も出てきます。よくある落とし穴を理解し、回避できるよう準備を進めることが重要です。
オンライン診療と比較すると、eConsent導入がメリットにつながる治験デザインの幅は広く、パイロット的な導入もしやすいのが特徴です。必ずしも対面でのeConsentからのトライアルではなく遠隔eConsentの検証も視野に入れ、協力的な施設を選定し、製薬企業内の経験を積んでいってはどうでしょうか。
はじめてのDCT、はじめてのeConsentの活用に向けては、是非、経験豊富な製薬企業の事例を参考にしたり、実績あるCROやITソリューションプロバイダーのノウハウを借りることも有益かもしれません。


